1.潍坊医学院内科学教研室,山东 潍坊 261053
2.潍坊市人民医院血液科,山东 潍坊 261041
[摘要] 目的 探讨异基因造血干细胞移植(Allo-SCT)与自体造血干细胞移植(Auto-SCT)作为多发性骨髓瘤一线治疗的意义。方法 检索Medline、Embase、the Cochrane Library数据库,检索时间从建库至2018年12月,共确定了六个试验,共计1871名受试者。本文采用Review Manager 5.1版软件对随机对照试验进行Meta分析。结果 Allo-SCT组与Auto-SCT组相比,完全反应率(CR)显著增高(RR,1.77 95%CI[1.23,2.55](p=0.002)),但无进展生存期(PFS)(HR 0.82 95%CI[0.64,1.04](p=0.10))和总生存期(OS)(HR 0.91 95%CI[0.67, 1.23](p=0.54))的差异无统计学意义,可能因被相对较高的治疗相关死亡率(TRM)所抵消(RR,3.42 95%CI[2.24,5.23](p<0.001))。结论 综上所述,与Auto-SCT相比,Allo-SCT作为多发性骨髓瘤患者的一线治疗,没有得到明显生存获益。
[关键词] 异基因造血干细胞移植(Allo-SCT);自体造血干细胞移植(Auto-SCT);多发性骨髓瘤(MM);生存获益
多发性骨髓瘤(MM)是一种浆细胞恶性肿瘤,发病率为血液系统恶性肿瘤的第二位。MM的主要症状有骨痛、贫血、肾功能下降以及感染等。含新药的诱导化疗联合自体造血干细胞移植(Auto-SCT)已成为65岁以下初治多发性骨髓瘤(MM)的标准一线治疗[1],异基因造血干
细胞移植(Allo-SCT)是MM的一种可能治愈方法,与Auto-SCT相比,复发率较低,部分患者可长期无病生存,然而,移植相关死亡率(TRM)达30%~50%限制了其使用[2]。采用非清髓异基因造血干细胞移植(NST)以减少TRM,重新引起了人们对于Allo-SCT治疗MM的兴趣。几个研究小组采用NST对已完成一次Auto-SCT的MM进行治疗,发现OS及PFS未能明显获益。然而,这些研究可能太小,不足以得出明确结论。因此,我们对已发表的研究进行了Meta分析,以探讨Allo-SCT的意义。
1 方法
1.1 文献检索策略
使用英文检索词为myeloma、autotransplantation、allotransplantation在Medline、Embase、the Cochrane Library的SCI数据库上检索随机对照研究,辅以手工检索和文献追溯,收集Allo-SCT与Auto-SCT一线治疗MM的比较研究。检索时限均从建库至2018年12月。
1.2 纳入标准
如果研究符合以下所有标准,则被纳入Meta分析:(1)这些研究发表截至2018年12月。(2)只对新诊断的多发性骨髓瘤患者进行治疗。(3)研究提供足够信息来计算PFS、OS、CR和TRM。(4)所有纳入试验均进行生物分配,而不是随机化程序。
1.3 结果测定
本次研究的主要结果是PFS和OS,次要结果是CR和TRM。
1.4 统计分析
我们用Cochraneχ2检验(认为在0.10水平显著)测试研究间的异质性,用I2统计量量化其程度。我们使用森林图来显示试验结果。所有Meta分析都是使用Review Manager软件完成的。统计学意义被定义为所有试验的P值均小于0.05。
2 结果
2.1 全面检索Medline、Embase、the Cochrane Library的SCI数据库,共产生939篇文章(关于这方面的研究在2012年后就很难再检索到了),其中六项研究符合预定的纳入标准,共纳入1871例患者。它们的特性见表1。
表1 纳入研究的特征
| 作者, 发表时间 | 例数 | 年龄 | 性别 (%) | 治疗方案 | 随访时间 | 病人选择 | ||
| 男性 | 女性 | |||||||
| Garban 2006[9] | E:65 | 54 (36-65) | 49.2 | 50.8 | Bu-Fluda-ATG | 28个月 | 高危 | |
| C:219 | 58 (28-65) | 52.1 | 47.9 | Mel 220±anti-IL6 | 24个月 | |||
| Bruno 2007 [13] Giaccone 2011 [8] | E:80 | 54 (34-65) | 51.3 | 48.7 | TBI 200cGy | 7.1年 | 无特殊选择 | |
| C:82 | 54 (33-65) | 57.3 | 42.7 | Mel 100 or (140-200) | ||||
| Rosinol 2008 [12] | E:25 | 52 ± 8 | - | - | Fluda-Mel140 | 5.2年 | 未完全缓解 | |
| C:85 | 52 ± 6 | - | - | CVB or Mel 200 | ||||
| Krishnan 2011[11] | E:226 | 53(29-68) | 58.4 | 41.6 | TBI 200cGy | 40个月 | 高危 标危 | |
| C:484 | 55(22-70) | 59.3 | 40.7 | Mel 200 | ||||
| Bjorkstrand 2011[14] | E:108 | 54(34-66) | 60.2 | 39.8 | Fluda-TBI 2Gy | 61个月 | 无特殊选择 | |
| C:249 | 57(31-69) | 58.6 | 41.4 | Mel 200 | ||||
| Lokhorst 2012[10] | E:124 | 54(32-65) | 58.2 | 41.8 | TBI 2Gy | 77个月 | 无特殊选择 | |
| C:124 | 54(30-65) | 67.4 | 32.6 | Mel 200 or maintenace | ||||
2.2 如图1所示,在MM的治疗上,Allo-SCT和Auto-SCT相比PFS的差异无统计学意义:PFS的汇总HR为0.82 95%CI[0.64,1.04](p=0.10)。研究之间的异质性高(p=0.002,I2=74%)。同样,图2显示了Allo-SCT和Auto-SCT相比OS的差异无统计学意义:OS的汇总HR为0.91 95%CI[0.67, 1.23](p=0.54)。研究之间的异质性高(p=0.003,I2=72%)。
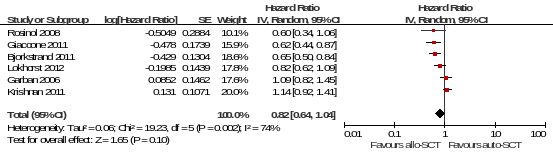
图1 Allo-SCT与Auto-SCT的PFS比较的Meta分析
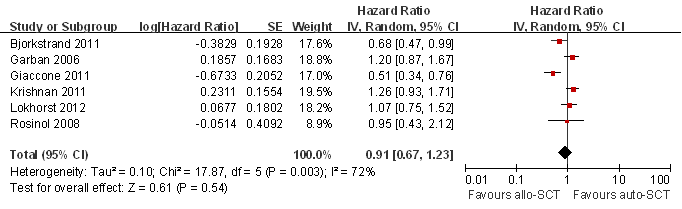 图2 Allo-SCT与Auto-SCT的OS比较的Meta分析
图2 Allo-SCT与Auto-SCT的OS比较的Meta分析
2.3 如图3图4所示,与Auto-SCT组相比,Allo-SCT组的CR显著更高(RR,1.77 95%CI[1.23,2.55](p=0.002)),然而并没有转化为生存获益,这是由相对较高的TRM所抵消的(RR,3.42 95%CI[2.24,5.23](p<0.001))。
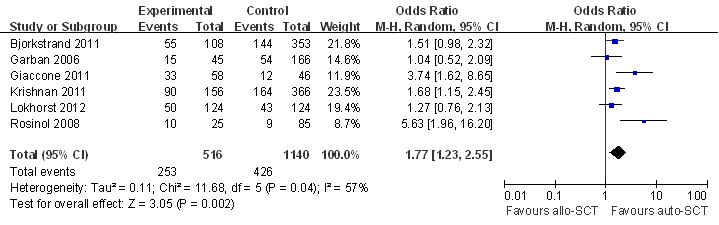 图3 Allo-SCT与Auto-SCT的CR比较的Meta分析
图3 Allo-SCT与Auto-SCT的CR比较的Meta分析
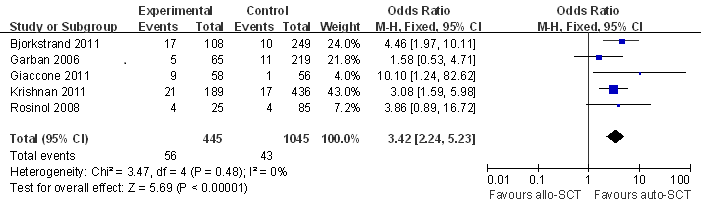 图4 Allo-SCT与Auto-SCT的TRM比较的Meta分析
图4 Allo-SCT与Auto-SCT的TRM比较的Meta分析
3 讨论
多发性骨髓瘤目前认为是不可治愈的疾病。新型靶向药物的应用以及Auto-SCT的发展,使MM的治疗有了较高的有效率。而Allo-SCT具有移植物抗骨髓瘤效应,被认为具有治愈MM的潜力,但由于具有较高的TRM,自临床引入以来一直争论不休。Allo-SCT的优势是移植物没有肿瘤细胞的污染,且具有移植物抗骨髓瘤效应(GVM),提高了患者的缓解深度。非清髓异基因造血干细胞移植(NST)可在维持GVM效应的同时,降低与清髓性Allo-SCT相关的毒性,然而郭智等人的研究表明,NST未能提高OS和PFS,原因可能是目前的NST方案还不足以将TRM降到足够低的水平。
本文对已发表的研究进行了Meta分析,以增加统计数据。我们发现Allo-SCT与Auto-SCT组相比,CR显著更高,而PFS和OS的差异并没有统计学上的显著意义,这是因被相对较高的TRM所抵消。尽管使用了非清髓性预处理方案,由于移植物抗宿主病(GVHD)和感染,自体-异体组与自体-自体组相比,TRM仍然很高。因此,改善Allo-SCT以降低TRM和增强GVM效应,将是未来干细胞移植技术在MM治疗领域的突破所在。
随着新药如来那度胺、硼替佐米、卡非佐米、伊沙佐米、daratumumab等的临床应用,MM的治疗取得了突飞猛进的进展,CR显著提高,PFS及OS明显延长[3]。如将来那度胺添加到供者淋巴细胞输注(DLI)中可以改善减低强度预处理患者的抗骨髓瘤效应,此外,研究显示,在Allo-SCT时给予硼替佐米可以抑制急性GVHD,同时可以保持GVM效应[4]。目前含新药的诱导化疗联合造血干细胞移植已成为65岁以下初治MM患者的标准治疗方案,加上移植后新药的维持治疗,使MM患者的疗效得到进一步提高[5]。然而Auto-SCT与Allo-SCT的选择问题上,目前尚无统一定论,需要根据患者的具体情况,如年龄、有无合适供着、是否具有遗传学高危因素等综合分析后作出最佳选择。
本文数据有助于更好地理解Allo-SCT作为MM患者一线治疗的意义。我们发现,与Auto-SCT相比,Allo-SCT的患者并没有得到明显生存获益。MM患者选择何种移植方式作为一线治疗,目前相关研究少,尚需大量临床研究进行深入分析,但无论如何都不应该一概而论,需要根据患者的具体情况来作出最明智最有利的选择。
参考文献
1.Garban F, Attal M, Michallet M, et al. Prospective comparison of autologous stem cell transplantation followed by dose-reduced allograft (IFM99-03 trial) with tandem autologous stem cell transplantation (IFM99-04 trial) in high-risk de novo multiple myeloma[J]. Blood, 2006, 107(9): 3474-3480.
2.Benedetto Bruno, M.D., Ph.D., et al. A Comparison of Allografting with Autografting for Newly Diagnosed Myeloma[J]. Blood, 2007, 13(11): 7024-7031.
3.Giaccone L, Storer B, Patriarca F, et al. Long-term follow-up of a comparison of nonmyeloablative allografting with autografting for newly diagnosed myeloma[J]. Blood, 2011, 117(24): 6721-6727.
4.Bo Bjorkstrand, Simona Iacobelli, Ute Hegenbart, et al. Tandem Autologous/Reduced-Intensity Conditioning Allogeneic Stem-Cell Transplantation Versus Autologous Transplantation in Myeloma: Long-Term Follow-Up[J]. Blood, 2011, 11(9): 635-642.
5.Lokhorst HM, van der Holt B, Cornelissen JJ, et al. Donor versus no-donor comparison of newly diagnosed myeloma patients included in the HOVON-50 multiple myeloma study[J]. Blood, 2012, 119(26): 6219-6225.
本文受潍坊市科技局发展项目(编号:2018YX049)资助
作者简介:苗家琪( 1993年 ~) ,女,山东潍坊人,在读硕士研究生。主要研究方向:多发性骨髓瘤的疾病特点与治疗。
通讯作者:冉学红,女,主任医师。