(1、兴安盟蒙医院,内蒙古兴安盟,137400;2、内蒙古民族大学蒙医药学院、内蒙古通辽,028000;3、内蒙古蒙医药工程技术研究院,内蒙古通辽,028000)
摘要 目的:建立铁杆蒿挥发油的GC-MS定性分析方法。方法:水蒸气蒸馏法提取铁杆蒿挥发油并对其挥发油进行GC-MS定性分析。结果:在实验所用的GC-MS色谱条件下,铁杆蒿挥发油化学成分分离效果较好,对其中5个化合物的质谱进行分析,确定了5个化合物的结构式分别为(-)-4-萜品醇、崁烯、按油精、樟脑和龙脑。结论:铁杆蒿挥发油的主要化学成分为单萜类化合物,单萜类化合物可能是铁杆蒿的有效成分之一。
关键词:铁杆蒿;挥发油; GC-MS
Abstract Objective: To establish GC-MS analysis methods for the volatile oil from Artemisa sacrorum. Method: The GC-MS method was used to analyze the chemical constituents of volatile oil from Artemisa sacrorum. Results: Under the condition of GC-MS chromatography, it is good in the isolation of the chemical constituents of volatile oil from Artemisa sacrorum. The mass spectra of 5 of these compounds were analyzed, and the structures of the compounds were identified. Conclusion: The main chemical constituents of volatile oil from Artemisa sacrorum were monoterpenoids, which may be one of the active components of which was The qualitative method for evaluating the quality of Agei rhinitis spray was established,
Keywords: Artemisa sacrorum.; Volatile oil; GC-MS; Refined oil; Camphor
铁杆蒿(Artemisa sacrorum Ledeb),蒙名哈热-沙巴克,系菊科植物万年蒿的干燥地上部分,是蒙古族历代和民间常用的特色蒙药。本品味苦,性凉,具有止痛、杀虫、消肿、收敛脓汁及黄水,制痧症,破痞之功效[1]。目前,铁杆蒿中分离得到化合物主要包括香豆素 [2, 3],有机酸类 [4], 萜类[5-8]和黄酮类化合物 [9]。但铁杆蒿挥发油化学成分方面研究报道[10]较少,为了摸清铁杆蒿挥发油的主要化学成分,并其以后药效学研究奠定基础,本文建立了其挥发油的GC-MS定性分析法,通过分离化合物的质谱数据分析,确定了5个化合物的结构,分别为崁烯、按油精、樟脑、龙脑和(-)-4-萜品醇。(图1)。

崁烯 按油精 樟脑 龙脑 (-)-4-萜品醇
图 1 铁杆蒿挥发油中5个化合物的结构式
1 实验材料
Termo Fisher Trace ISQ型GC-MS联用仪(美国热电); 色谱柱为TR-5MS (30 m × 0.25 mm I.D. × 0.25 µm film);移液枪100-1000l(YE169AA0042667);环乙烷(山东西亚化学股份有限公司,批号:P6567)为色谱纯。铁杆蒿(Artemisa sacrorum Ledeb)于2017年6月采集于内蒙古通辽,经布和巴特尔教授(内蒙古民族大学蒙医药学院蒙药教研室)鉴定为菊科植物万年蒿的干燥地上部分,样品(批号:2017060201)储存于内蒙古民族大学蒙药化学实验室。
2 方法与结果
2.1. 铁杆蒿挥发油的制备
取干燥的铁杆蒿1000.0 g,放置100000 mL圆底烧瓶中,内加70000 mL水与适量沸石;按中国药典挥发油提取方法,提取时间为10 h,冷却,收集挥发油,计算其得率。结果得到铁杆蒿挥发油,经无水硫酸钠干燥后,得到绿黄色油状液体2.5 mL,其得率为0.25%。取挥发油100L加环己烷900L过0.22 m有机过滤膜,即得。
2.2. GC-MS分析
2.2.1 色谱条件:以TR-5MS (30 m × 0.25 mm I.D. × 0.25 m film) 为色谱柱;氦气为载气;柱温程序升温(起始温度50 ℃,保持2 min,以20 ℃ • min-1升温至70 ℃,以2.0 ℃ • min-1升温至90℃保持5 min,以5.0 ℃ • min-1升温至140 ℃保持5 min,以5.0 ℃ • min-1升温至200 ℃)进样量1L;
质谱条件:电离方式为EI,电子能力为50eV,离子源温度350 ℃,气化室温度为250℃,接口温度350 ℃,溶剂延迟时间3 min,全扫面模式采集,扫描范围m/z 40~600。在上述色谱条件下分离的铁杆蒿挥发油色谱图见图2。
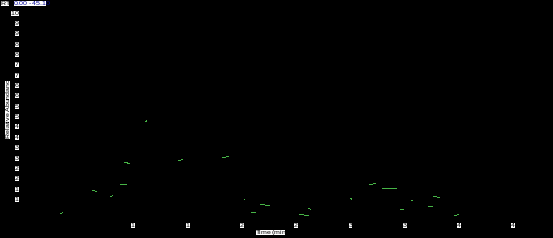
图2 铁杆蒿挥发油 GC-MS色谱图
2.3 质谱分析:
2.3.1 崁烯质谱数据分析:从图2可知,崁烯保留时间(tR)为7.01 min。从图3可知,其分子离子峰质荷比(m/z)为136,主要碎片离子有m/z为121、93和79。通过其分子离子峰和主要碎片离子的数据及其裂解过程(图4)的分析,确定其结构式(图1)。
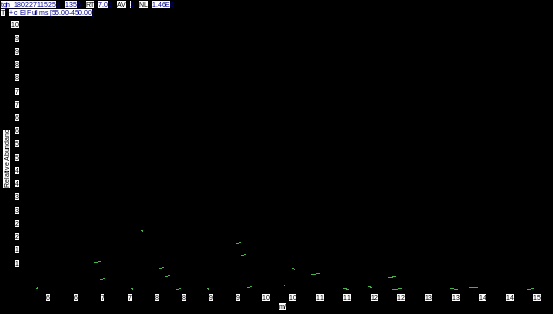
图 3 崁烯质谱图
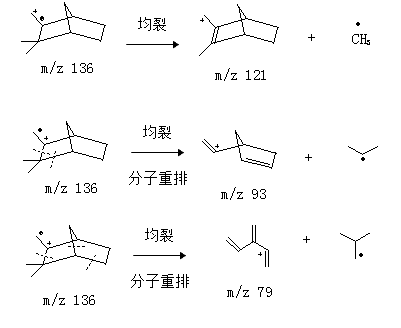
图 4 崁烯裂解过程图
2.3.2 按油精质谱数据分析:从图2可知,按油精保留时间(tR)为9.96 min。从图5可知,其分子离子峰质荷比(m/z)为154,主要碎片离子有m/z为139、111、108、83、81和71。通过其分子离子峰和主要碎片离子的数据及其裂解过程(图6)的分析,确定其结构式(图1)。
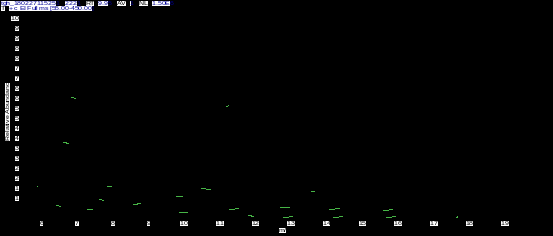
图5 桉油精质谱图
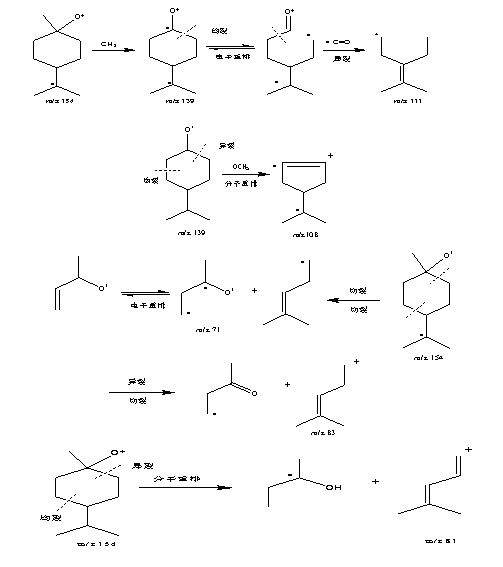
图 6 按油精裂解过程图
2.3.3 樟脑质谱数据分析:从图2可知,樟脑保留时间(tR)为15.9 min。从图7可知,其分子离子峰质荷比(m/z)为152,主要碎片离子有m/z为110、95、83、81和69。通过其分子离子峰和主要碎片离子的数据及其裂解过程(图8)的分析,确定其结构式(图1)。
图7 樟脑质谱图
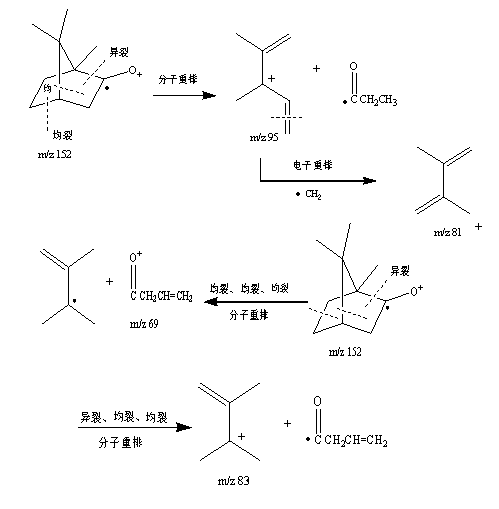
图 8 樟脑裂解过程图
2.3.4 龙脑质谱数据分析:据图2可知,龙脑的保留时间为17.6 min。从图9可知,其分子离子峰质荷比(m/z)为154,主要碎片离子有m/z为136、121、95。通过其分子离子峰和主要碎片离子的数据及其裂解过程(图10)的分析,确定其结构式(图1)。
图 9 龙脑质谱图
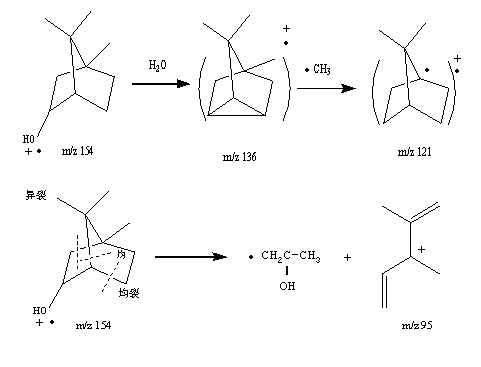
图 10 龙脑裂解过程图
2.3.5 (-)-4-萜品醇质谱数据分析:据图2可知,(-)-4-萜品醇的保留时间为18.0 min。从图11可知,其分子离子峰质荷比(m/z)为154,主要碎片离子有m/z为136、111、93和71。通过其分子离子峰和主要碎片离子的数据及其裂解过程(图12)的分析,确定其结构式(图1)。
图11 (-)-4-萜品醇质谱图
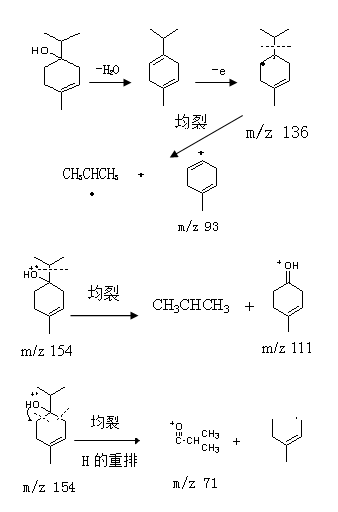
图12 (-)-4-萜品醇裂解过程图
3 讨论
3.1 从崁烯裂解过程(图4)可知,质荷比(m/z)为121的碎片离子是由分子离子峰失去一个自由基(CH3)而形成的;m/z 93的碎片离子是分子离子峰双键α位和β位同时均裂并分子重排而形成的;m/z 79的碎片离子是分子离子峰环内多处同时均裂并分子重排而形成的。
3.2 从按油精裂解过程(图6)可知,质荷比(m/z)为139的碎片离子是由分子离子峰失去一个自由基(CH3)而形成的;碎片离子(m/z 111)是碎片离子(m/z 139)的氧α位先均裂并电子重排,从而再异裂失去C=O自由基而形成的;碎片离子(m/z 108)是碎片离子(m/z 139)的氧两则α和β位分别产生异裂和均裂并分子重排而形成的;m/z 83和71的碎片离子是分子离子峰通过不同位置发生异裂和均裂而形成的;m/z 81的碎片离子是分子离子峰通过不同位置发生异裂和均裂并分子重排而形成的。
3.3 从樟脑裂解过程(图8)可知,质荷比(m/z)为95的碎片离子是分子离子峰通过不同位置发生异裂和均裂并分子重排而形成的;碎片离子(m/z 81)是碎片离子(m/z 95)通过均裂并电子重排失去CH2而形成的;碎片离子(m/z 83和69)是分子离子峰通过不同位置发生异裂和均裂并分子重排而形成的。
3.4 从龙脑裂解过程(图10)可知,质荷比(m/z)为136的碎片离子是分子离子峰失去H2O而形成的;碎片离子(m/z 121)是碎片离子(m/z 136)通过失去一个自由基(CH3)而形成的;碎片离子(m/z 95)是分子离子峰环内多处同时均裂并分子重排而形成的。
3.5 从(-)-4-萜品醇裂解过程(图12)可知,质荷比(m/z)为95的碎片离子是分子离子峰通过不同位置发生异裂和均裂并分子重排而形成的;碎片离子(m/z 81)是碎片离子(m/z 95)通过均裂并电子重排失去CH2
而形成的;碎片离子(m/z 83和69)是分子离子峰通过不同位置发生异裂和均裂并分子重排而形成的。
分子离子峰通过不同位置发生异裂和均裂并分子重排而形成的;碎片离子(m/z 81)是碎片离子(m/z 95)通过均裂并电子重排失去CH2而形成的;碎片离子(m/z 83和69)是分子离子峰通过不同位置发生异裂和均裂并分子重排而形成的。
参考文献
[1] BAI Q Y. Chinese Med Encyclopaedia-Mongolian Med (中国医学百科全书) [M]. Shanghai: Shanghai Science & Technology Press, 1992: 200.
[7] Zhang DZ, Li X, Wu LJ. Studies on coumarins from Artemisa sacrorum Ledeb [J]. Chin. Trad. Herb. Drug. (中草药), 1989, 20 (11): 7-9.
[8] Zhang DZ, Li X. Studies on the aromatic constituents from Artemisa sacrorum Ledeb [J]. Chin. Trad. Herb. Drug. (中草药), 1993, 24 (6): 283-288.
[6] Zhang DZ, Hu R. Study on the chemical constituents of essential oil from Artemisa sacrorum Ledeb [J]. Journal of Jilin Forestry Institute (吉林林学院学报), 1992, 8 (3): 1-4.
[2] Zhang D Z. Studies on New Susquiterpenes in Artemisa sacrorum Ledeb [J]. Guangdong Weiliang Yuansu Kexue (广东微量元素科学), 2006, 13 (5): 59-63.
[3] Zhang D Z, Li X, Zhu Y R. Studies on structure of diterpenes from Artemisa sacrorum Ledeb [J]. Fenxi Ceshi Tongbao (分析测试通报), 1990, 9 (4): 27-31.
[4] Zhang D Z. Isolation and identification of two new diterpenes from Artemisa sacrorum Ledeb [J]. Nat. Prod. Res. Dev. (天然产物研究与开发), 1998, 10 (4): 34-37.
[5] Wu L J, Ban X D, Wang C X. Study on the chemical constituents of Artemisa sacrorum Ledeb [J]. J. Shenyang Pharm. Univ. (沈阳药科大学学报), 1994, 11 (1): 54-56.
[9] Zhang DZ, Li X, Zhu YR. Study on the chemical constituents of Artemisa sacrorum Ledeb [J]. J. Shenyang Pharm. Univ. (沈阳药科大学学报), 1990, 6 (2): 146-148.
[10] 顾静文, 刘立鼎, 陈京达,等. 铁杆蒿精油的化学成分[J]. 江西科学, 1999, 17 (3): 187-189.
8