山东省济南市历城区遥墙镇(遥墙校区) 邮编:250107
摘要
人们生活水平日渐提高以及运动量的不足,导致近年肥胖流行病,且肥胖患者较正常人更易格患冠心病、高血压、高脂血症、糖尿病、脑血管意外、骨关节炎、呼吸睡眠暂停等,特别是内脏脂肪堆积常伴随胰岛素抵抗或2型糖尿病、高尿酸血症等所谓的代谢综合征发生。因此寻找一种安全有效的药物临床治疗肥胖症以及相关并发症具有重大的意义。雷公藤红素来源于中药雷公藤的根,过去人们通过大量的体内和体外实验发现它具有广泛的药理学作用,如抗炎、抗氧化、抗肿瘤等。最近研究显示雷公藤红素还具有降血压,缓解高血压引起的炎症反应的药效,相关文献表明炎症反应和肥胖症之间存在着一种恶性循环,所以炎症反应的发生是肥胖症治疗的关键。另外有文献报导它在改善db/db 小鼠糖尿病肾病的同时,还可以降低血糖,这些研究提示雷公藤红素在代谢类疾病如糖尿病中也可能发挥作用,但其作用方式和具体机制仍不清楚,有待进一步探讨。
本研究借助于肥胖和2型糖尿病模型小鼠,db/db小鼠,给予不同剂量的雷公藤红素(0.2 mg/kg、0.4 mg/kg)治疗14天,结果显示,雷公藤红素降低db/db小鼠肝脏内质网应激相关分子的表达,减少内质网应激引起的脂质堆积,进而增强了db/db 小鼠胰岛素敏感性,显著降低血糖。此外,我们使用饱和脂肪酸处理原代肝细胞以建立胰岛素抵抗模型,进一步探讨雷公藤红素缓解胰岛素抵抗的可能机制,体外结果提示雷公藤红素通过提高AKT磷酸化水平,促进胰岛素信号通路的传导,最终增加肝细胞对葡萄糖的摄取和糖原含量。
Nur77介导雷公藤红素通过自噬损伤线粒体达到抗炎作用进而引起减肥效果。
线粒体在维持机体代谢健康中发挥重要作用,而线粒体功能障碍会导致肥胖和相应的代谢紊乱。肥胖引起的炎症导致代谢紊乱,进而引发许多肥胖相关的疾病,如:二型糖尿病,脂肪肝,血脂异常与动脉粥样硬化等。在健康情况下,线粒体通过给细胞提供ATP,控制能量消耗,协调ROS的产生和调节细胞凋亡等方式来调控机体代谢平衡。然而,肥胖则会引起线粒体上部分氧化物质的积累和线粒体上ROS生产异常ROS和氧化物质的大量积累又反过来会导致线粒体功能异常。雷公藤红素促使Nur77出核至因持续炎症刺激引起的损伤线粒体上,与TRAF2相互作用诱导Nur77的泛素化,从而与自噬相关蛋白p62相互作用后导致线粒体自噬,从而清除损伤线粒体,进而缓解炎症及肥胖疾病。
综上所述,本研究首次探讨了雷公藤红素的减肥作用,结果表明该药物通过减轻内质网压力,减少了脂质沉积,进而增强肝脏胰岛素敏感性,促进肝对葡萄糖的摄取和糖原合成,从而有效降低db/db小鼠的血糖。我们的研究提示雷公藤红素可以成为治疗肥胖症的潜在药物。
关键词:肥胖症,2型糖尿病,雷公藤红素,db/db小鼠,诱导Nur77,胰岛素抵抗,内质网应激,脂质堆积
实验探讨
雷公藤红素对db/db小鼠体重的影响
给药的14天中,我们检测了各组小鼠的体重,结果显示给药前后小鼠体重没有显著性差异(图1A)。将各组小鼠给药后体重涨幅进行比较可知,db/db组与Ctl组小鼠相比,体重增长的很快。0.2mg/kg剂量的CLS组与db/db组相比,体重涨幅无显著性差异,当药物剂量加倍即0.4mgkg时,小鼠体重增长幅度与db/db组相比显著下降(图1B)。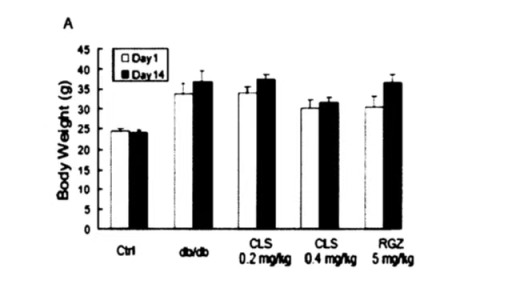
雷公廉红素对小鼠体重的影响。A:给药前后各组小鼠体重进行比较;B:各组小鼠给药体重涨幅进行比较。#表示与Ctrl组相比,p<0.01,**表示与db/db组相比,p<0.01。
雷公藤红素减少db/db小鼠肝脏脂质堆积,增加肝糖原含量
肝脏作为糖脂代谢的中枢器官,在机体能量稳态的维持方面发挥重要作用。肝脏脂代谢平衡被打破,导致脂肪在肝脏中的异位堆积,容易引起胰岛素抵抗,肝脏胰岛素抵抗表现为肝糖输出增多,糖摄取减少,降低了以糖为底物的糖原合成,导致肝糖原含量减少。为了观察雷公藤红素对db/db小鼠肝脏脂质堆积和糖原的影响。我们通过HE染色观察各组小鼠肝细胞内脂质沉积的情况。结果显示Ctrl组肝组织结构完整、清晰,无脂肪堆积,db/db小鼠肝细胞肿胀,胞浆内可见很多大小不等的脂滴空泡,而CLS组空泡数量减少(图2A)。提示药物处理可以明显减少脂质在小鼠肝脏中的蓄积。接下来我们对肝脏进行高碘酸雪夫染色(图2B),结果发现与Ctrl组相比,db/db组小鼠肝糖原明显减少,而雷公藤红素治疗后,肝糖原增加。
雷公藤红素对db/db小鼠肝脏脂质堆积和糖原的影响。A.肝脏固定过夜,石蜡包埋和切片后,进行HE染色,在显微镜下观察小鼠肝脏中脂质的分布情况;B.肝脏固定过夜,石蜡包埋和切片后,进行高碘酸雪夫染色,在显微镜下观察小鼠肝脏中糖原的分布情况。(×100)
雷公藤红素减少原代肝细胞脂质沉积
雷公藤红素通过减轻内质网压力,减少了肝内脂质堆积,恢复脂代谢平衡,增强肝脏胰岛素敏感性。为了探讨雷公藤红素在体外小鼠原代肝细胞中是否可以同样缓解脂质堆积引起的胰岛素抵抗,我们使用饱和脂肪酸棕榈酸(Palmitate,简称Palm)刺激作为脂毒性模型,Palm处理肝细胞12h,内质网应激标志分子CHOP的表达显著增强,Palm处理肝细胞24h,油红O染色结果显示,此时肝细胞中红色脂滴显著增多。而雷公藤红素处理后,CHOP表达下降,肝细胞脂滴蓄积减少。表明在体外肝细胞中,雷公藤红素可能通过改善内质网内环境的稳态,减少了脂质堆积。



分析与讨论
脑卒中,糖尿病等肥胖症的并发症,已严重威胁人类健康与生命安全。在本研究中,我们选择db/db小鼠作为研究对象,该小鼠瘦素受体突变,具有极度肥胖、多食、消渴、多尿等临床症状,并伴有胰岛素抵抗、高胰岛素、高血糖、高血脂、脂肪肝等症状,与肥胖症及人类2型糖尿病病理特点相似。本实验采用两个药物浓度:0.2mgkg和0.4mg/kg,连续的腹腔注射14天,观察给药后小鼠体重以及血糖变化,结果显示这两个浓度的药物均能够有效降低小鼠体重及血糖。雷公藤红素通过减轻内质网压力,减少了肝内脂质堆积,恢复脂代谢平衡,增强肝脏胰岛素敏感性,从而起到减肥降血糖的作用。
小结
本研究利用2型糖尿病小鼠模型,db/db小鼠以及体外培养的原代肝细胞,观察雷公藤红素对糖尿病小鼠血糖和胰岛素抵抗的改善作用,并探讨其可能的作用机制,得出以下结论:
1.游离的脂肪酸可以引起肝脏内质网应激,促进肝脏脂质堆积;
2.雷公藤红素显著减少由内质网应激导致的肝脏脂质沉积;
3.肝细胞内脂质堆积,影响胰岛素受体介导的信号通路传导,表现为肝糖原合成减少;
4.雷公藤红素改善胰岛素信号通路传导,提高胰岛素敏感性,促进肝脏摄取葡萄糖,增加肝糖原含量,最终使血糖下降。
本研究为雷公藤红素在肥胖症及其并发症的疾病中的应用提供了理论基础。
参考文献
[1] Despres JP,et al.Abdominal obesity and metabolic syndrome. Nature, 2006.444(7121):881-7.
[2] Weiss R,et al. Obesity dynamics and cardiovascular risk factor stability in obese adolescents. Pediatr Diabetes 2009.10(6):360-7.
[3] Sun HK,et al. Phosphodiesterase inhibitor improves renal tubulointerstitial hypoxia of the diabetic rat kidney. Korean J Intern Med, 2012.27(2):163-70.[4] Goto H,et al. Endothelial MnSOD overexpression prevents retinal VEGF expression in diabetic mice. Biochem Biophys Res Commun,2008.366(3):814-20.
[5] Zhao H, et al. Inhibiting glycosphingolipid synthesis improves glycemic control and insulin sensitivity in animal models of type 2 diabetes. Diabetes,2007.56(5):1210-8.
[6] Ferrannini E,et al. Insulin resistance and hypersecretion in obesity. European Group for the Study of Insulin Resistance (EGIR). J Clin Invest, 1997.100(5):1166-73.
[7] Saltiel AR. New perspectives into the molecular pathogenesis and treatment of type 2 diabetes. Cell, 2001.104(4):517-29.
[8] Hotamisligil GS. Endoplasmic reticulum stress and the inflammatory basis of metabolic disease. Cell,2010.140(6):900-17.
[9] Bakker W, et al. Endothelial dysfunction and diabetes: roles of hyperglycemia, impaired insulin signaling and obesity. Cell Tissue Res,2009.335(1): 165-89.
[10] Ozcan U, et al. Endoplasmic reticulum stress links obesity, insulin action, and type 2 diabetes. Science, 2004.306(5695):457-61.
[11] Kahn BB,et al. Obesity and insulin resistance. J Clin Invest, 2000.106(4):473-81.