海南钧华医疗科技有限公司 海南海口 571924
华益泰康药业股份有限公司海南海口 570311
摘要:近年来,口服制剂在药物制剂研究中得到快速发展。在口服制剂中,其生物利用度、治疗效果以及胃肠道环境中药物活性成分的释放能力、吸收能力等均与药物的溶出度有密切关系。因此在对口服制剂进行质量评价时往往需要对其溶出度进行检测。溶出度试验目前不仅应用于口服制剂中,在透皮制剂、微球等剂型均均有应用,当前对制剂溶出度的检测多采用篮法与浆法进行检测,但是由于药物中溶出介质以及药物辅料理化性质的不同,使药物在溶出度检测中的区分力较低。基于此,本文对口服制剂具有区分力的溶出度方法进行探讨,以期能够为处方开发、质量控制及临床用药提供借鉴依据。
关键词:肠溶缓释制剂;溶出度;区分力;方法选择
前言:
近年来,随着医药行业的快速发展,各类仿制药层出不穷,但是在仿制药中,其质量却与原研药存在一定的差异。口服制剂作为目前最为常见的主要药物剂型,其质量检测对于药物的药效以及生物利用度有着中有作用,通过进行溶出度检查能够对仿制药与原研药之间的差异进行明确,并对处方工艺、制备方法进行评估,甚至可作为预测药物体内吸收、排泄等行为的重要方式。由于口服制剂主要在机体胃肠道内进行溶剂、吸收,进入血液循环发挥药效,但是由于药物以及药用辅料等理化性质的不同,使制剂在机体内呈现出易溶解与难溶解的差异,使生物利用度存在显著差异,由此可知,药物的溶出速度是药物在机体内发挥作用的重要因素。基于此,在本文中对肠溶缓释制剂的溶出度检测方式进行探讨,及探求提升溶出度检测方法的区分力,为药物的质量提升以及处方优化等提供依据。
一、药物溶出度的检测
溶出度主要为药剂在一定溶出介质及条件下其药物活性成分的溶出速度与程度。对于药物溶出度的测试通常采用体外试验法,通过模拟人工胃液或人工肠液及不同PH值的缓冲溶液等,进行溶出速率的检测。药物溶出度检测在口服制剂中可作为评价药剂质量以及制备工艺水平的重要方式,在一定程度上反映药物的处方组成、生产工艺等方面与原研药的差异,进行质量与疗效的一致性评价。在药物溶出度的检测中,溶出介质PH、溶出转速以及测定时间点、含量测定方法等均会对药物溶出度的检测结果产生严重影响。在溶出介质PH的选择中,对于不同的口服制剂,药物溶出度检测中溶出介质的PH值液各不相同,通常来说对于酸性药物的口服制剂,其PH值在1.0或1.2、5.5-6.5或6.8-7.5范围内,而中性或碱性药物的口服制剂其溶出介质PH值在3.0-5.0或6.8左右,肠溶性口服制剂溶出介质PH值则在6.0或6.8左右。因此,在实际检测过程中,为明显区分出药剂质量,应当根据药剂体内吸收部位的环境PH值以及药物的稳定性、药用辅料的理化性质等对溶出介质PH值进行选定。在溶出转速的选择,以桨法进行溶出度测定时一般选用50-75转速,而采用转篮法中可选用50-100转速。而对于测定时间,则可根据药物为肠溶制剂或普通制剂,为缓释制剂或控释制剂等进行测定时间的确定,一般对于肠溶制剂可为6h,缓释制剂可至24h。目前在药物溶出度的测定中,为测定药剂内药物活性成分的含量,通常采用UV法或HPLC法进行,从而计算溶出度,绘制溶出曲线。
二、肠溶缓释制剂的溶出度检测方法
肠溶缓释片由于在制备中包括片芯与肠溶包衣两部分,其中肠溶包衣作为包括片芯防止片芯在胃内释放的包衣膜,具有一定的耐酸性,以避免胃酸对片芯产生影响,使药物能够在肠道碱性环境下缓慢稳定缓解,因此,在肠溶缓释制剂的溶出度检测中通常需通过碱性溶出介质进行释放度评价。但是在传统的肠溶缓释制剂溶出度检测方法中,常采用篮法或桨法进行,以固定PH的溶出介质进行释放度测定,而该种方式对于PH依赖型药物难以满足当下进行处方筛选和质量比较研究的要求。且由于肠溶缓释制剂在胃肠道内的实际溶出情况存在一定差异,溶出度检测方法的区分度问题能够严重影响到对制剂体内外效应的预测,对药剂质量以及处方优化、制备方式优化等造成障碍。因此,在对于肠溶缓释制剂的溶出度检测当中,应当采用更具有区分力的检测方式进行肠道环境内的释放度检测。
三、提升区分力的溶出度方法优化——以盐酸帕罗西汀肠溶缓释片为例
由于口服制剂仅有在体内溶出时其中的药物活性成分才能被机体吸收,因此一种口服制剂在被制备出来后需进行体内外溶出度试验。药物体内外溶出特性存在一定相关性,从药物的体外溶出特性可反映出制剂在体内的溶出行为,因此通过区分力较强的溶出度检测方法能够客观评价制剂的制备质量,并从原料药的理化性质、制备处方和制备工艺等方面区分药物制剂的质量差异,提高药物的安全性与有效性。由于盐酸帕罗西汀肠溶缓释片的溶出方法目前仅被进口药品注册标准与美国药典收载,因此对其提升区分力的溶出度方法进行优化研究,进行释放度测定。肠溶缓释片由于在机体肠道内进行释放,因此通常为在碱性介质中释放,其肠溶包衣膜往往具有耐酸性,而在进口药品注册标准与美国药典所收载的溶出度测定方法中均通过酸性介质后再进行碱性介质中的溶出度测定,从而难以排除肠溶层对药物活性成分的释放影响,使体外溶出检测的区分力效果降低,无法区分药品间的质量差异。
因此,采用桨法进行溶出度检测,对所收载的PH7.5缓冲液改进为PH6.0±0.05的缓冲液,对盐酸帕罗西汀肠溶缓释片进行释放度测定。
3.1溶出介质的制备
称取108.88g磷酸二氢钾荣誉4L水中,制成0.2mol/L磷酸二氢钾溶液。将3500ml的0.2mol/L磷酸二氢钾溶液与392ml的0.2mol/L氢氧化钠溶液混合,加水稀释至14L,摇匀,并用0.2mol/L氢氧化钠溶液调节PH6.0±0.05。溶出介质再使用前需加热至42℃,并脱气5分钟。
3.2供试品溶液的制备
将盐酸帕罗西汀肠溶缓释片6粒溶解于溶出杯中的溶出介质内,每个溶出杯放置1粒肠溶缓释片,并添加溶出介质1000ml。溶出介质温度为37.5±0.5摄氏度。设置搅拌桨转速为每分钟50-75转,于2h、4h、6h、8h、12h、16h、20h分别取溶液5ml,同时补充相同温度、相同体积的溶出介质,取续滤液作为供试品溶液。
3.3对照品溶液的制备
精密称取盐酸帕罗西汀半水合物对照品约25mg,置于100ml量瓶中,加入5ml甲醇,超声2分钟使其溶解,用溶出介质稀释至刻度线,摇匀,即得对照品母液。精密移取3ml对照品母液置于20ml量瓶中,用溶出介质稀释至刻度线,即得对照品溶液。
3.4高效液相色谱条件
Agilent高效液相色谱仪,色谱柱Agilent ZoRBAxTMS,4.6×250mm,5μm,柱温30℃,体积比为60:40:1的乙腈:PH4.5缓冲液:三乙胺为流动相,流速为1.0ml/min.PH4.5和缓冲液由7.8醋酸铵用纯化水溶解并稀释至200ml,用冰醋酸调节PH至4.5所得。
3.5液相色谱测定
分别取对照品溶液和供试品溶液各40μL,通过HPLC在295nm下进行检测。以外标法进行峰面积计算,分别计算在不同时间内的释放度,绘制成释放度曲线。
3.6释放度检测结果
将原料药对照释放去向与75转速、150转速、100转速与50转速下的释放度曲线进行比较。其中例1中采用PH6.0磷酸盐缓冲液介质在转速75转/分钟下进行释放度检测,例2为于PH7.5Tris缓冲液于150转速下进行测定,例3为PH7.5Tris缓冲液于100转速下进行测定,例4为于PH6.0磷酸盐缓冲溶出介质下50转速进行测定。其结果如下图所示。

图1
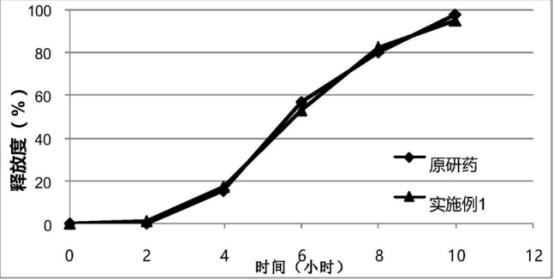
图2

图3

图4
由释放度测定结果可了解到,在PH6.0介质下进行的肠溶缓释片测定,与对照品原研药在同一条件下的测定结果比较中可见,两者在释放度曲线的变化趋势中并无明显差异,但是在释放速率上却略低于原研药,可见该种溶出度检测条件能够区分出制剂的质量差异。在PH7.5介质下150转速的释放度曲线种可见,对照品原研药曲线与该供试品检测曲线的变化趋势相同,可见在PH7.5Tris缓冲液150转速条件下溶出法的区分力不足。在PH7.5Tris缓冲液100转速下,检测所得的释放度曲线与对照品同一条件下的释放度曲线并无明显差异,可见在该条件下难以明显区分原研药与药剂的差异。而在PH6.0磷酸盐缓冲液50转速条件下,供试品检测所得释放度曲线与对照品原研药释放度曲线在变化趋势上具有一致性,但供试品药物得释放速率略低于对照品原研药,可见该种条件下的溶出度检测方法能够较好的区分制剂的质量差异。由此可知,在对盐酸帕罗西汀肠溶缓释片的溶出度检测当中,可在PH6.0磷酸盐缓冲溶液的溶出介质下进行溶出度检测,可获得具有较高区分度的释放度曲线,具有较好的溶出度测定准确性,使制剂质量进行明确对比。
四、结语
综上所述,在对口服制剂溶出度检测的区分力研究当中,为提升对药剂与原研药之间的差异,可从溶出介质PH值以及溶出转速等方面进行优化改善。在以盐酸帕罗西汀肠溶缓释片为例的溶出法优化过程中,发现在PH6.0±0.05的磷酸盐缓冲液介质下,以50、75转速均可与原研药表现出较高区分力,进行质量对比。可见,该种溶出度测定方法具有较强区分力,对药剂的处方优化、制备方式优化以及质量控制等具有借鉴意义。
参考文献:
[1]李伊娜,张娜,刘万卉等.往复筒法在药物溶出度研究中的应用进展[J].药物分析杂志,2021,41(02):185-194.
[2]李玲. 阿司匹林肠溶片溶出度一致性评价[D].上海交通大学,2018.
[3]邱湘龙, pH依赖型口服结肠定位释药薄膜包衣预混辅料. 浙江省,温州小伦包衣技术有限公司,2010-07-17.
[4]傅小红,姜伟,万婷等.HPLC法用于西咪替丁片含量及溶出度的测定研究[J].云南化工,2022,49(08):62-65.