1.江西省上饶市铅山县疾病预防控制中心,铅山334500
2.江西省疾病预防控制中心业务管理科,南昌 330029
【摘要】目的:利用Meta分析的方法探讨非复制型病毒载体(VVnr)新冠疫苗接种不良反应情况。方法:电子检索PubMed、Embase、中国知网、万方、维普检索有关VVnr新冠疫苗安全性和不良反应的随机对照试验研究,检索年限为2019年12月至2023年6月。应用Stata 14.0 软件进行Meta分析。结果:共纳入4篇文献9项RCT研究。结果表明在局部不良反应方面,与安慰剂对照相比,接种VVnr新冠病毒疫苗更容易引起接种部位肿胀(OR=5.62[1.92-16.43])、疼痛(OR=12.56[5.80-27.23])、瘙痒(OR=10.56[1.36-81.95])、硬结(OR=4.74[1.05-21.44])、红斑(OR=2.97[1.73-5.10])等不良反应;但在接种部位发红方面(OR=2.25[0.35-14.38]),差异无统计学意义。在全身不良反应方面,与安慰剂对照相比,接种VVnr新冠病毒疫苗更容易引起头痛(OR= 3.14[1.89-5.23])、恶心(OR= 1.33[1.09-1.63])、乏力(OR= 4.43[2.42-8.11])、食欲减退(OR=3.55[1.43-8.83])、全身肌肉酸痛(OR=8.59[2.29-32.27])、全身红斑(OR=6.06[2.48-14.83])、发热(OR=6.35[2.52-15.96]);但在呕吐、腹泻、咳嗽、全身瘙痒等方面,差异无统计学意义。结论:相较于安慰剂,接种VVnr新冠病毒疫苗更容易引起局部和全身不良反应。
【关键字】VVnr;新冠肺炎;疫苗;Meta分析
Analyzing the side effects of the VVnrCOVID-19 Vaccine
LI Zhenxiong1, DONG Yonghai2, LIU Yun3
1.Yanshan Center for Disease Control and Prevention, Shangrao City, Jiangxi Province, 334500, China
2.Business Management pision, Jiangxi Center for Disease Control and Prevention, Nanchang 330029, China
3.Department of Imaging, Jiangxi Provincial People's Hospital, Nanchang 330006, China
[Abstract] The purpose of this meta-analysis is to investigate the unfavorable effects of the non-replicating viral vectors (VVnr) COVID-19 vaccine. METHODS: From December 2019 to June 2023, randomized controlled trial studies on the safety and side effects of VVnr COVID-19 vaccine were retrieved using electronic searches in PubMed, Embase, China Knowledge, Wanfang, and Weipu. Stata 14.0 was used to conduct the meta-analysis. RESULTS: There were a total of 9 RCT trials from 4 articles. The results showed that in terms of local adverse reactions, vaccination with VVnr COVID-19 vaccine was more likely to cause swelling (OR=5.62 [1.92-16.43]), pain (OR=12.56 [5.80-27.23]), itching (OR=10.56 [1.36-81.95]), and hardness (OR=4.74 [1.05-21.44]), and erythema (OR=2.97 [1.73-5.10]) adverse reactions; however, in terms of redness at the vaccination site (OR=2.25 [0.35-14.38]), the difference was not statistically significant. In terms of systemic adverse reactions, vaccination with VVnr COVID-19 vaccine was more likely to cause headache (OR= 3.14 [1.89-5.23]), nausea (OR= 1.33 [1.09-1.63]), malaise (OR= 4.43 [2.42-8.11]), and loss of appetite (OR= 3.55 [1.43-8.83]), as compared to placebo control, generalized muscle soreness (OR=8.59 [2.29-32.27]), generalized erythema (OR=6.06 [2.48-14.83]), and fever (OR=6.35 [2.52-15.96]); however, the differences were not statistically significant in vomiting, diarrhea, cough, and generalized itching.
Conclusion: When compared to a placebo, vaccination with the VVnr COVID-19 vaccine is more likely to result in local and systemic adverse effects.
[Keyword] VVnr; COVID-19; Vaccination; Meta-analysis
为应对全球范围的新冠病毒疫情,各国纷纷加快了新冠疫苗的开发[1-7]。在已进入临床应用阶段的180种疫苗中,非复制型病毒载体(Viral Vector non-replicating,VVnr)新冠疫苗占25种(14%)[8]。随着VVnr新冠疫苗在全球范围内的大规模接种,对其安全性和不良反应的评价成为一个重要的议题[9-10]。虽然临床试验和实际接种过程中已经进行了安全性监测和评估,但由于样本量有限、可观察时间较短等原因,对于不良反应的全貌和特点尚不充分了解。因此,进行一项基于现有研究结果的Meta分析,可以更全面地评估VVnr新冠疫苗的不良反应情况,为疫苗接种政策和公众健康提供更有力的科学依据。
1材料与方法
1.1 文献检索策略
通过PubMed、Embase、中国知网、万方、维普检索有关VVnr新冠疫苗安全性和不良反应的电子文献研究。检索关键词为:英文数据库-(COVID-19 OR 2019 Novel Coronavirus Disease OR SARS Coronavirus 2 OR SARS-CoV-2 OR Severe Acute Respiratory Syndrome Coronavirus 2 ) AND (Vaccine OR Vaccines) AND (Randomized Controlled Trial OR Randomized Controlled Trials OR Randomized Trials OR Randomized Trial OR RCT OR RCTs) AND(safety OR adverse reaction OR side reaction);中文数据库-(COVID-19 OR 新冠 OR 新型冠状病毒)AND (疫苗) AND (随机对照研究) AND (安全性 OR 不良反应 OR副反应)。检索时间自2019年12月至2023年6月。整个检索过程由课题组两位检索员分别独立开展检索。文献检索流程见图1。

图1 文献检索流程图
1.2 文献筛选标准
依据PICOS原则制定纳入和剔除标准。纳入标准:(1)研究对象不限性别和年龄;(2)研究分为接种VVnr新冠疫苗组和安慰剂对照组;(3)研究提供了接种疫苗后产生不良反应的结果数据;(4)研究设计类型为随机对照研究(RCT)。不限定研究文献语言类型。排除综述、病例报道、动物实验等。当纳入的文献研究筛选有歧义时,由第三位研究者评估后决定。
1.3 文献数据提取
设立两名文献数据提取员分别独立进行数据提取。提取内容包含第一作者、发表年份、研究地区、干预组和对照组的接种疫苗数、产生不良反应数等。
1.4 文献质量评价
参照Newcastle-Ottawa Scale (NOS)进行文献质量评价,评价的内容由选择、筛选、结果三个部分。≤3 星为低质量,4-6 星为中等质量,7-11星为高质量。
1.5 统计分析
采用 Stata 14.0软件meta分析包进行统计分析。本研究以OR值及95%CI为统计效应指标。Cochran's Q和 I2 评价各研究的异质性。I2以50%为界值,小于50%为异质性低,反之,则认为异质性高。采用随机效应模型进行效用量的估计。以Begg's检验进行发表偏倚评价。以P<0.05为差异有统计学意义。
2 结果
2.1 文献研究基本情况
经检索PubMed、Embase、中国知网、万方、维普,初步检索到787篇文献,经查重后剩余668篇,经最终严格筛选共纳入4篇文献。经NOS文献质量评价,4项研究均为高质量。在本研究中,如某文献同时报告了不同疫苗接种剂量的研究结果,则视为不同的研究,因此共有9项研究。纳入研究的基本情况见表1。
表1 纳入文献研究基本情况
第一作者 | 发表年份 | 调查地区 | 研究对象 | 调查时间 | 新冠疫苗 | 文献质量评价 |
Sadoff(1)[11] | 2021 | Argentina,Bra zil,Chile,Colombia,Mexico,Peru,South Africa,and the United States. | 18-59 岁 | 2020年9月21日-2021年1月22日 | Ad26.COV2.S vaccine | 8 |
Sadoff(2)[11] | 2021 | Argentina,Bra zil,Chile,Colombia,Mexico,Peru,South Africa,and the United States. | ≥60岁 | 2020年9月21日-2021年1月22日 | Ad26.COV2.S vaccine | 8 |
Zhu(1)[12] | 2020 | China | ≥18岁 | 2020年4月11日-16日 | non-replicating adenovirus type-5 (Ad5)-vectored COVID-19 vaccine,Vaccine at 1*10^11vp | 9 |
Zhu(2)[12] | 2020 | China | ≥18岁 | 2020年4月11日-16日 | non-replicating adenovirus type-5 (Ad5)-vectored COVID-19 vaccine,Vaccine at 5 ×10^¹⁰vp | 9 |
Halperin[9] | 2021 | Argentina,Chile,Mexico,Pakistan,and Russia. | ≥18岁 | 2020年7月-8月 | Ad5-nCoV vaccine | 8 |
Tsuchiya(1)[10] | 2023 | Japan | 20-55 岁 | 2020年8月-2021年2月 | Ad26.COV2.S,5*10 vp | 9 |
Tsuchiya(2)[10] | 2023 | Japan | 20-55 岁 | 2020年8月-2021年2月 | Ad26.COV2.S,10*10 vp | 9 |
Tsuchiya(3)[10] | 2023 | Japan | ≥65岁 | 2020年8月-2021年2月 | Ad26.COV2.S,5*10 vp | 9 |
Tsuchiya(4)[10] | 2023 | Japan | ≥65岁 | 2020年8月-2021年2月 | Ad26.COV2.S,10*10 vp | 9 |
2.2局部不良反应
合并纳入研究中报告了局部不良反应的结果,显示与安慰剂对照相比,接种VVnr新冠病毒疫苗更容易引起接种部位肿胀(OR=5.62[1.92-16.43])、疼痛(OR=12.56[5.80-27.23])、瘙痒(OR=10.56[1.36-81.95])、硬结(OR=4.74[1.05-21.44])、红斑(OR=2.97[1.73-5.10])等不良反应,差异有统计学意义;但在接种部位发红方面(OR=2.25[0.35-14.38]),差异无统计学意义(见图2)。

图2 接种VVnr新冠疫苗与安慰剂对照的不良反应森林图
2.3全身不良反应
合并纳入研究中报告了全身不良反应的结果,显示与安慰剂对照相比,接种VVnr新冠病毒疫苗更容易引起头痛(OR= 3.14[1.89-5.23])、恶心(OR= 1.33[1.09-1.63])、乏力(OR= 4.43[2.42-8.11])、食欲减退(OR=3.55[1.43-8.83])、全身肌肉酸痛(OR=8.59[2.29-32.27])、全身红斑(OR=6.06[2.48-14.83])、发热(OR=6.35[2.52-15.96]),差异有统计学意义;但在呕吐、腹泻、咳嗽、全身瘙痒等方面,差异无统计学意义(见图3)。
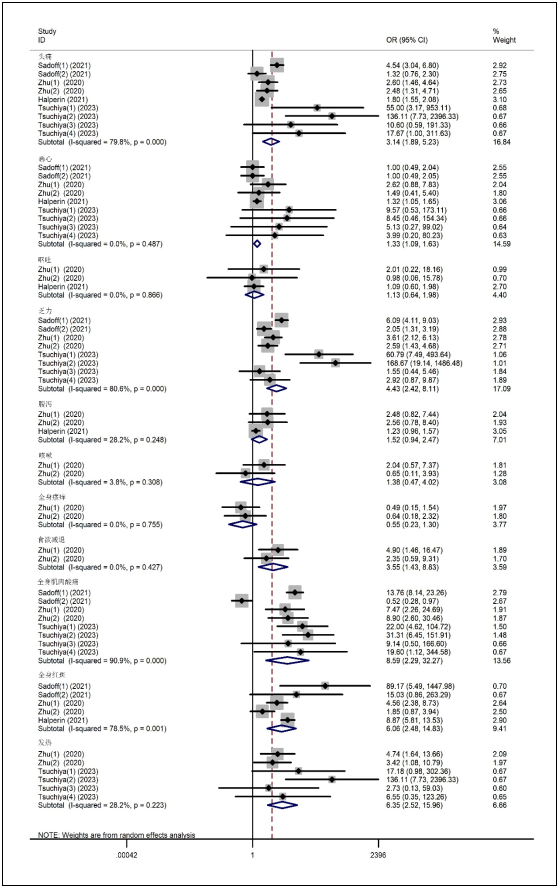
图3 接种VVnr新冠疫苗与安慰剂对照的不良反应森林图
2.4 发表偏倚评估
对纳入的4篇文献9项研究,经Begg’s 检验发现,P均>0.05,差异无统计学意义,表明无文献发表偏倚。
3 讨论
在本研究中,课题组进行了一项关于非复制型病毒载体新冠疫苗接种不良反应的meta分析,根据课题组阅读文献发现这也是首次进行该种类型新冠病毒疫苗接种不良反应的系统评价。
本研究结果显示,在局部不良反应方面,接种VVnr新冠病毒疫苗相对于安慰剂对照组,更容易引发接种部位肿胀、疼痛、瘙痒、硬结和红斑等不良反应的发生(P<0.05),但在接种部位发红方面,差异无统计学意义(P>0.05)。这些结果与既往研究结果基本一致[13-14],进一步支持了新冠疫苗接种后会产生一定的局部不良反应。局部不良反应通常是短暂和轻微的,往往自行消退。然而,在个别个体中,这些不良反应可能会导致一定的不适和不便,需要医务人员关注。
在全身不良反应方面,课题组观察到接种VVnr新冠病毒疫苗与安慰剂对照组相比,更容易引发头痛、恶心、乏力、食欲减退、全身肌肉酸痛、全身红斑和发热等不良反应(P<0.05)。这些结果也与现有的临床试验数据基本一致,进一步加强了疫苗接种后全身不良反应的认知。与局部不良反应相比,全身不良反应往往更明显,并可能对接种者的生活质量产生一定的影响。
需要注意的是,不良反应的发生与剂量和接种强度等因素有关[15-16]。本课题研究结果来自于多个随机对照研究的综合分析,不同研究的疫苗剂量和接种方法可能存在一定的差异。因此,对于具体的接种剂量和接种模式,可能会对不良反应的发生率和严重程度产生影响。今后的研究可以进一步探究不同剂量和接种方案对不良反应的影响,以便更好地了解和管理疫苗接种相关的不良反应。
此外,还需关注不良反应的长期安全性[17]。尽管本研究主要关注了短期的不良反应,但在疫苗接种后的长期安全性方面仍存在一定的不确定性。随着疫苗使用的持续推进,我们需要进行更长时间的追踪研究,以评估疫苗在更大样本上的长期安全性。
本研究存在一定的局限性。一是本研究主要关注了VVnr新冠疫苗的不良反应,而未对其他类型的新冠疫苗进行分析。因此,本研究结果仅适用于VVnr新冠疫苗,在推广到其他类型的疫苗时需要谨慎解读。其次,研究间可能存在一定的异质性,如不同研究的样本特征、疫苗剂量和接种方式的差异等。这些因素可能对结果产生一定影响,并需要更多研究来进一步验证。
尽管存在这些局限性,本研究仍具有一定的临床意义。首先,我们的研究结果为VVnr新冠疫苗的安全性提供了重要的依据。不良反应是评估疫苗接种安全性的重要指标之一,本研究的结果可以帮助医务人员和公众更全面地了解疫苗的风险与益处,从而做出更准确的决策。其次,我们的研究强调了全身不良反应在VVnr新冠疫苗接种后普遍存在性,这提醒我们在接种后应留意可能出现的一系列不良反应,并及时就医咨询。最后,我们的研究也为进一步研究疫苗接种后的不良反应提供了思路和参考,未来的研究可以深入探究疫苗成分、剂量和接种方式等因素对不良反应的影响,有助于优化疫苗的安全性和接种策略。
综上所述,本研究通过Meta分析的方法系统阐述了VVnr新冠疫苗接种后的局部和全身不良反应。接种部位肿胀、疼痛、瘙痒、硬结、红斑是主要的局部不良反应表现,头痛、恶心、全身肌肉酸痛、全身红斑、发热则是主要的全身不良反应表现。通过对不良反应的深入研究,能够更好地评估疫苗的安全性和有效性,并为公众提供可靠的疫苗接种指导。今后我们将继续关注VVnr新冠病毒疫苗剂量、接种强度和长期安全性等因素对不良反应的影响。
参考文献
[1] Barbari A. COVID-19 Vaccine Concerns: Fact or Fiction?[J]. Exp Clin Transplant, 2021, 19(7): 627-634.
[2] Gordon C, Porteous D, Unsworth J. COVID-19 vaccines and vaccine administration[J]. Br J Nurs, 2021, 30(6): 344-349.
[3] Hadj HI. Covid-19 vaccines and variants of concern: A review[J]. Rev Med Virol, 2022, 32(4): e2313.
[4] Kamidani S, Rostad CA, Anderson EJ. COVID-19 vaccine development: a pediatric perspective[J]. Curr Opin Pediatr, 2021, 33(1): 144-151.
[5] Soleimanpour S, Yaghoubi A. COVID-19 vaccine: where are we now and where should we go?[J]. Expert Rev Vaccines, 2021, 20(1): 23-44.
[6] Tregoning JS, Flight KE, Higham SL, et al. Progress of the COVID-19 vaccine effort: viruses, vaccines and variants versus efficacy, effectiveness and escape[J]. Nat Rev Immunol, 2021, 21(10): 626-636.
[7] Wibawa T. COVID-19 vaccine research and development: ethical issues[J]. Trop Med Int Health, 2021, 26(1): 14-19.
[8] World Health Organization. COVID-19 vaccine tracker and landscape[EB/OL]. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. 2023-06-20.
[9] Halperin SA, Ye L, Mackinnon-Cameron D, et al. Final efficacy analysis, interim safety analysis, and immunogenicity of a single dose of recombinant novel coronavirus vaccine (adenovirus type 5 vector) in adults 18 years and older: an international, multicentre, randomised, double-blinded, placebo-controlled phase 3 trial[J]. The Lancet, 2022, 399(10321): 237-248.
[10] Tsuchiya Y, Tamura H, Fujii K, et al. Safety, reactogenicity, and immunogenicity of Ad26.COV2.S: Results of a phase 1, randomized, double-blind, placebo-controlled COVID-19 vaccine trial in Japan[J]. Vaccine, 2023, 41(9): 1602-1610.
[11] Sadoff J, Gray G, Vandebosch A, et al. Safety and Efficacy of Single-Dose Ad26.COV2.S Vaccine against Covid-19[J]. The New England journal of medicine, 2021, 384(23): 2187-2201.
[12] Zhu F, Guan X, Li Y, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial[J]. The Lancet, 2020, 396(10249): 479-488.
[13] Kaur RJ, Dutta S, Bhardwaj P, et al. Adverse Events Reported From COVID-19 Vaccine Trials: A Systematic Review[J]. Indian J Clin Biochem, 2021, 36(4): 427-439.
[14] Mastellos DC, Skendros P, Lambris JD. Is complement the culprit behind COVID-19 vaccine-related adverse reactions?[J]. J Clin Invest, 2021, 131(11).
[15] Moreira EJ, Kitchin N, Xu X, et al. Safety and Efficacy of a Third Dose of BNT162b2 Covid-19 Vaccine[J]. N Engl J Med, 2022, 386(20): 1910-1921.
[16] Roth MS, Chantraine S, Morales MC, et al. Safe administration of subsequent mRNA COVID-19 vaccine doses following a possible allergic reaction to the first dose[J]. J Eur Acad Dermatol Venereol, 2022, 36(11): e880-e883.
[17] Sadat LM, Sorouri R, Eybpoosh S, et al. Assessment of long-term adverse events regarding different COVID-19 vaccine regimens within an 18-month follow-up study[J]. Pathog Dis, 2023, 81.
【基金】江西省卫生健康委科技计划项目(项目编号:202210076)
作者简介:李振雄(1968年-),男,江西上饶人,本科,副主任医师,研究方向:传染性流行病学。
△通讯作者:董永海(1984年-),男,硕士,副主任医师,研究方向:疾病控制。Email:dyhai123@126.com。