广东广青金属科技有限公司,广东 阳江 529500;广东省高端不锈钢研究院有限公司,广东 阳江 529500;广东省高品质不锈钢技术研发企业重点实验室,广东 阳江 529500;广东省新型研发机构,广东 阳江 529500
[摘 要]试样在高温下用过氧化钠熔融分解,用热水浸出熔融物质,用硫酸酸化,用高锰酸钾作为氧化剂在一定酸度下氧化低价铬,再用氯化铵还原过量高锰酸钾,最后用硫酸亚铁铵滴定N-苯基邻氨基苯甲酸作为指示剂。用该方法分析操作简单,迅速,使用试剂少,分析结果准确可靠。
[关键词] 高碳铬铁; 铬; 碱熔; 高锰酸钾;氯化铵
[中图分类号]O65 [文献标识码]A [文章编号]
高碳铬铁中碳元素的的含量较高,碳含量一般在4 %~8 %。由于铬元素和碳元素的亲和力比碳元素和铁元素的亲和力大,所以铬的碳化物要比铁的碳化物更容易生成,铬元素可以取代部分铁元素与碳元素形成(Fe,Cr)3C, (Fe,Cr)C3及(Fe,Cr)23C6等复杂的碳化物,此外,铬元素和氮元素还可形成氮化物(CrN,Cr2N)。碳化铬和氮化铬的化学稳定性高,用酸不能完全溶解高碳铬铁。现有一般的分析方法是碱熔-过硫酸铵氧化亚铁滴定法分析,本文以此分析方法通过大量实验进行优化改进,减少了试剂使用,简化了分析步骤,缩短了分析时间。经过大量实验分析证明,改良后的分实验方法可以得出稳定、可靠结果,能够快速及时报出准确分析数据,能够满足工厂日常快节奏生产的分析需求。
1 实验部分
1.1方法要点及化学反应方程式
试样用过氧化钠在高温下熔融:
2FeCr+9Na2O2=2Na2CrO4+2NaFeO2+6Na2O
Cr3C2+13Na2O2=3Na2CrO4+2CO2↑+10Na2O
水浸取熔融物:
NaFeO2+2H2O=Fe(OH)3↓+NaOH
Na2O2+Na2O+2H2O=4NaOH+H2O2
硫酸酸化:
2Na2CrO4+2H2SO4=H2Cr2O7+2Na2SO4+H2O
过氧化氢可能将部分高价铬还原:
H2Cr2O7+H2O2+3H2SO4=Cr2(SO4)3+2O2↑+5H2O
高锰酸钾氧化三价铬至六价:
Cr2(SO4)3+2KMnO4+2H2O=H2Cr2O7+2MnO2↓+K2SO4+2H2SO4
过量高锰酸钾和二氧化锰以氯化铵消除:
2KMnO4+MnO2+12NH4Cl+10H2HSO4=3MnSO4+K2SO4+6(NH4)2SO4+6Cl2↑+10H2O
滴定氧化还原反应:
H2Cr2O7+6(NH4)2Fe(SO4)2+6H2SO4=Cr2(SO4)3+6(NH4)2SO4+3Fe3(SO4)3+7H2O
1.2 分析试剂和仪器设备
1.2.1 试剂
过氧化钠(分析纯);
硫酸(1+1);
磷酸(分析纯);
高锰酸钾(50 g/L);
氯化铵(饱和溶液);
硫酸亚铁铵标准溶液(0.080 mol/L);
N-苯基邻氨基苯甲酸指示剂(4 g/L)。
1.2.2 仪器设备
瓷坩埚(40 ml);
分析天平;
马弗炉;
电炉;
500 ml烧杯;
50 ml酸式滴定管。
1.3 实验方法
称取试验样品0.1000±0.0002 g,放置于40 ml的瓷坩埚中,称取4 g的过氧化钠固体于瓷坩埚中,搅拌均匀,盖上瓷坩埚盖,将坩埚放置于设置为660 ℃的马弗炉中熔融7分钟,取出瓷坩埚自然冷却至60~70 ℃左右,将瓷坩埚和坩埚盖放置于盛有80℃左右的100 ml去离子水的500 ml烧杯中,浸取出熔融物,缓缓加入30 ml硫酸(1+1)酸化溶液,用去离子水清洗出瓷坩埚和坩埚盖,加入6 ml磷酸(分析纯),加入沸水于烧杯使溶液至200 ml,加入1 ml高锰酸钾(50 g/L),放于电炉上加热至沸腾1分钟,加入10 ml氯化铵(饱和溶液),继续加热沸腾直至溶液变成橙黄色清亮透明,取下用流水冷却至室温,然后用硫酸亚铁铵标准溶液(0.080 mol /L)滴定,一边滴定一边搅拌,滴定至溶液呈绿色,加入N-苯基邻氨基苯甲酸指示剂(4 g/L)3滴,继续用硫酸亚铁铵标准溶液滴定至亮绿色为终点。
按下式计算结果:
![]()
其中式中:c—硫酸亚铁铵标准溶液的浓度,mol/L
V—滴定所消耗硫酸亚铁铵标准溶液的体积,ml
m—称取分析试样的质量,g
0.01733 —1.00 ml的 1.00 mol/L浓度硫酸亚铁铵标准溶液相当于铬的质量,g
2试验讨论
2.1 熔解试样容器的选择
在以往的一些分析方法中使用镍坩埚作为容器熔解试样,镍坩埚在高温溶解中,由于过氧化钠的强氧化性、强腐蚀性,镍坩埚中的成份也随之熔解在试样中,对分析造成影响,镍坩埚在每次熔解厚度都会减少,容易造成镍坩埚穿孔,为保证实验的稳定需频繁更换新坩埚,从而使分析成本增加。本文方法使用瓷坩埚作为容器熔解,使用瓷坩埚熔融物容易清洗,不会增加试样外的物质,且成本低。经过大量实验证明使用瓷坩埚,对分析结果没有影响,分析结果准确、稳定。
2.2 过氧化钠的用量
具有强氧化性的过氧化钠可以有效熔解高碳铬铁,高温熔解下,铬被氧化成六价铬 。过氧化钠的用量很关键,用量少样品不能完全熔解,用量过大会造成浪费,增加分析成品。过多的过氧化钠会使溶液含碱量大,在后续酸化步骤会增加硫酸的用量,且多余的过氧化钠会产生过多的过氧化氢,在没酸化的碱性溶液中,过氧化氢不会还原六价铬,随着加入硫酸把溶液酸化,过氧化氢会将六价铬还原成三价铬。
表格1 过氧化钠用量的分析验证
Table 1 Analysis and verification of sodium peroxide dosage
样品编号 | 标准植/% | Na2O2/g | 测定值(n=6) | 平均值/% | 标准偏差/% | ||
YSBC28655-2018 | 53.45 | 2 | 43.44 42.87 | 43.11 42.46 | 42.54 42.98 | 42.83 | 0.47 |
3 | 53.36 53.42 | 53.44 53.48 | 53.37 53.59 | 53.44 | 0.085 | ||
4 | 53.55 53.60 | 53.46 53.55 | 53.33 53.44 | 53.49 | 0.098 | ||
6 | 53.36 53.46 | 53.42 53.40 | 53.34 53.52 | 53.42 | 0.066 | ||
7 | 53.56 53.55 | 53.31 53.41 | 53.33 53.45 | 53.44 | 0.011 | ||
从表1的实验结果可以得出,过氧化钠的用量过少样品不能完全熔解,用量在3g以上样品可以被完全熔解,为了保证分析实验的稳定性和经济性,本方法最终选用4 g过氧化钠。需要注意的是过氧化钠与样品必须搅拌均匀,否则样品堆积在坩埚底部不能被完全熔解。过氧化钠的熔点为460 ℃,沸点为657 ℃,温度在沸点以上,熔融状态下的过氧化钠在沸腾时容易飞溅出来,造成试样损失,影响结果,所以需盖上瓷坩埚盖。
2.3 溶液的酸度
本实验方法使用高锰酸钾作为氧化剂将少量的三价铬氧化成六价,铬的氧化速度与溶液中硫酸的酸度有关,酸度过大,铬氧化速度缓慢,可能结果分偏低,酸度太小,有二氧化锰生成,影响铬的氧化。使用过硫酸铵作为氧化剂,需要把过量的过硫酸铵通过煮沸来去除,否则影响实验结果,且煮沸去除过量的过硫酸铵也消耗时间,增加实验时长。使用高锰酸钾作氧化剂可节省去除过硫酸铵的时间,0.1 g的铬完全被氧化理论上需要0.3 g的高锰酸钾,因大部分铬都已经被过氧化钠氧化,只有小部分铬在酸性溶液中被产生的过氧化氢还原,使用高锰酸钾(50 g/L)只需1 ml即可,可通过观察溶液颜色有![]() 的紫红色即可判断铬已被完全氧化,紫色消失补加高锰酸钾。在相关文献中,在硫酸介质中最佳的酸度为c(H2SO4)1.0~2.0 mol/L,在此硫酸酸度的溶液中煮沸2分钟高锰酸钾即可把铬完全氧化。过量的高锰酸钾和二氧化锰通过加入饱和氯化铵溶液来还原去除。高价锰的还原速度与溶液的酸度密切相关。
的紫红色即可判断铬已被完全氧化,紫色消失补加高锰酸钾。在相关文献中,在硫酸介质中最佳的酸度为c(H2SO4)1.0~2.0 mol/L,在此硫酸酸度的溶液中煮沸2分钟高锰酸钾即可把铬完全氧化。过量的高锰酸钾和二氧化锰通过加入饱和氯化铵溶液来还原去除。高价锰的还原速度与溶液的酸度密切相关。
表格2 酸度对锰还原的分析验证
Table 2 Analysis and verification of manganese reduction by acidity
样品编号 | 标准值/% | 酸度/mol/L | 还原时间/min | 测定值(n=6) | 平均值/% | 标准偏差/% | ||
YSBC28655-2018 | 53.45 | 0.60 | 5 | 53.55 53.78 | 53.97 53.39 | 53.76 53.96 | 53.74 | 0.23 |
0.80 | 3 | 53.46 53.52 | 53.34 53.45 | 53.47 53.49 | 53.46 | 0.06 | ||
1.0 | 1.5 | 53.48 53.63 | 53.56 53.54 | 53.43 53.39 | 53.51 | 0.06 | ||
1.2 | 1 | 53.33 53.47 | 53.42 53.44 | 53.44 53.52 | 53.44 | 0.06 | ||
1.4 | 1 | 53.56 53.46 | 53.34 53.41 | 53.38 53.43 | 53.43 | 0.08 | ||
从表2中的实验结果可看出,当硫酸酸度在0.8~1.4 mol/L时实验的的精密度和准确度都很好,![]() 的还原时间在3分钟内完成,酸在0.6 mol/L时个别结果明显偏高,说明还有少量的
的还原时间在3分钟内完成,酸在0.6 mol/L时个别结果明显偏高,说明还有少量的![]() 的没有还原,使果偏高,分析结果精密度和准确度都不理想。从实验的效率、经济性、准确性、稳定性考虑,本文实验的酸度最终选择加入30 ml硫酸(1+1),约1.15 mol/L的硫酸浓度,这也与铬的最佳氧化酸度相同。磷酸的酸度变化对铬的氧化影响比较小,本实验方法溶液磷酸酸度为0.5 mol/L,磷酸的存在可以避免煮沸时生成二氧化锰沉淀,磷酸在滴定时能与Fe(Ⅲ)生成无色的Fe(HPO4
的没有还原,使果偏高,分析结果精密度和准确度都不理想。从实验的效率、经济性、准确性、稳定性考虑,本文实验的酸度最终选择加入30 ml硫酸(1+1),约1.15 mol/L的硫酸浓度,这也与铬的最佳氧化酸度相同。磷酸的酸度变化对铬的氧化影响比较小,本实验方法溶液磷酸酸度为0.5 mol/L,磷酸的存在可以避免煮沸时生成二氧化锰沉淀,磷酸在滴定时能与Fe(Ⅲ)生成无色的Fe(HPO4![]() 络阴离子,使Fe3+的浓度下降,从而使得Fe3+/Fe2+电对的电位降低,使滴定终点的电位突跃范围扩大,N-苯基邻氨基苯甲酸的变色电位恰好落入突跃范围的电位内,让指示剂能有效指示滴定终点,终点更容易识别。
络阴离子,使Fe3+的浓度下降,从而使得Fe3+/Fe2+电对的电位降低,使滴定终点的电位突跃范围扩大,N-苯基邻氨基苯甲酸的变色电位恰好落入突跃范围的电位内,让指示剂能有效指示滴定终点,终点更容易识别。
2.4 高碳铬铁的熔解时间和温度
使用过氧化钠熔解高碳铬铁需要在高温下才能有效、完全熔解,过氧化钠的熔点为460 ℃,以460 ℃起试验不同温度和时间下高碳铬铁的熔解程度,以下是用铬含量标准值为53.45 %的标准样品YSBC28655-2018的试验数据。
表格3熔解程度与温度、时间的分析验证
Table 3 Analysis and verification of melting degree, temperature and time
| 460 | 520 | 580 | 640 | 700 | 760 | 820 |
| |||||||
4 | 34.44 | 34.42 | 35.35 | 43.32 | 50.87 | 51.54 | 50.42 |
5 | 34.56 | 34.76 | 36.29 | 52.45 | 52.38 | 52.78 | 50.66 |
6 | 34.55 | 35.25 | 36.35 | 53.47 | 53.54 | 53.42 | 51.65 |
7 | 35.34 | 35.78 | 40.46 | 53.58 | 53.37 | 53.53 | 52.45 |
8 | 36.22 | 36.76 | 42.56 | 53.60 | 53.58 | 53.11 | 52.02 |
9 | 38.45 | 37.77 | 47.35 | 53.39 | 53.54 | 53.03 | 52.60 |
10 | 40.68 | 43.89 | 45.75 | 53.44 | 53.01 | 53.00 | 52.89 |
从表3的试验结果可以看出,当温度在640 ℃,熔解6分钟开始得出的实验结果与标准值相当。当温度在700 ℃,熔解6分钟至9分钟,实验结果与标准值相当。温度在760 ℃下,熔解6分钟至7分钟,实验结果与标准值相当。随着温度升高和时间延长,实验结果反而偏低,这是因为长时间过高的温度使得熔融物牢牢附着在坩埚上,很难浸出在水中。过高的温度会使瓷坩埚表面的釉面熔解,以至熔融物清洗很困难。温度太低、时间太短样品不能完全被熔解,温度太高、时间太长熔融物不容易被清洗浸出。综上所述,实验熔解温度选择为660 ℃,时间选择7分钟。
2.5 氯化铵还原过量的高价锰
为了消除过量的高锰酸钾对分析的干扰,需要把高价锰还原成二价锰,本方法使用氯化铵饱和溶液作为还原剂,需要注意的是,加入氯化铵后煮沸溶液![]() 紫色消失,变成橙黄色清亮透明即可,煮沸的时间不宜过长,且要立即用流水冷却,否则煮沸时间过长Cr2
紫色消失,变成橙黄色清亮透明即可,煮沸的时间不宜过长,且要立即用流水冷却,否则煮沸时间过长Cr2![]() 可能被还原,使结果偏低。如溶液没完全呈清亮透明,可适当补加氯化铵。
可能被还原,使结果偏低。如溶液没完全呈清亮透明,可适当补加氯化铵。
2.6 N-苯基邻氨基苯甲酸指示剂
用硫酸亚铁铵溶液滴定时,Cr2![]() 被还原为三价铬:
被还原为三价铬:
6Fe2++ Cr2![]() +14H+=6Fe3++2Cr3++7H2O
+14H+=6Fe3++2Cr3++7H2O
在滴定过程中溶液的电位不断发生变化,由于加入了磷酸使滴定终点的电位突跃范围扩在为1.31~0.73V,而N-苯基邻氨基苯甲酸指示剂的变色电位为1.08V,因此指示剂对滴定终点的指示性很有效,且终点颜色明显清楚容易辨别。
指示剂反应:
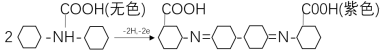
N-苯基邻氨基苯甲酸的变色反应机理比较复杂,其是氧化还原指示剂,指示剂本身也会对分析实验产生影响,因此指示剂的加入量不宜过多,且加入量必须准确一致,在分析铬含量高的样品时,滴定时宜先加入硫酸业铁铵滴定溶液,将大部分的Cr2![]() 还原,溶液呈绿色后再加入指示剂,以免指示剂被破坏,作精确分析时应加以补正。
还原,溶液呈绿色后再加入指示剂,以免指示剂被破坏,作精确分析时应加以补正。
3分析方法结果验证
采用上文实验得出的方法对高碳铬铁标准样品进行验证分析。
表4 高碳铬铁标准样品的验证分析
Table 4 Verification analysis of high carbon ferrochrome standard samples
样品编号 | 标准值/% | 测定值(n=6) | 平均值/% | 标准偏差/% | ||
YSBC28654-2018 | 54.25 | 54.34 54.29 | 54.40 54.24 | 54.34 54.20 | 54.30 | 0.07 |
YSBC28655-2018 | 53.45 | 53.44 53,47 | 53.53 53.33 | 53.55 53.40 | 53.45 | 0.09 |
BH0310-3 | 58.37 | 58.33 58.44 | 58.46 58.26 | 58.33 58.35 | 58.36 | 0.08 |
YSBC28624-2010 | 60.00 | 60.06 59.96 | 60.10 60.11 | 60.12 59.91 | 60.04 | 0.09 |
YSBC37648-10 | 61.54 | 61.55 61.42 | 61.62 61.65 | 61.49 61.55 | 61.55 | 0.08 |
从表4的分析结果可以看出,本实验方法所得出实验数据的重复性在0.07~0.09之间,准确度和精密度都符合分析要求。
4结论
通过以上实验可以证明,采用碱熔-高锰酸钾氧化硫酸亚铁铵还原滴定法分析高碳铬铁中的铬,该实验分析方法快速,准确,稳定,可靠,分析步骤简便易于操作,减少了化学试剂的用量,无需加入Ag+作催化剂。缩短了实验时间,降低实验成本,适合批量分析样品。可以满足工厂日常快速生产的需求。
参考文献
[1]吴 诚. 金属材料化学分析300问[M]. 上海: 上海交通大学出版社,2003.
[2]陈必友,李启华. 工厂分析化验手册[M].北京: 化学工业出版社,2002.
[3]贺红侠,许鸿英,詹 娟,等. 高碳铬铁中铬元素快速滴定分析[J]. 河北冶金,2016,224(4):75-76
[4]丁振东,杜 浩,邓金玲. 高碳铬铁中铬的快速分析方法[J]. 理化检验-化学分册,2003,39(8):489
[基金项目] 广东省科技计划项目(2023B1212070017); 阳江市科技计划项目(RCZX2023011); 省科技创新专项资金(“大专项+任务清单”)项目(SDZX2023003)
[作者简介] 吴 航(1988-),男,广东阳春人,助理工程师,主要研究方向为冶金化工分析。